Tofacitinib citrate är ett receptbelagt läkemedel (varunamn Xeljanz) som ursprungligen utvecklades av Pfizer för en klass av orala Janus kinas (JAK)-hämmare. Det kan selektivt hämma JAK-kinas, blockera JAK/STAT-vägar och därigenom hämma cellsignaltransduktion och relaterat genuttryck och aktivering, som används för att behandla reumatoid artrit, psoriasisartrit, ulcerös kolit och andra immunsjukdomar.
Läkemedlet innehåller tre doseringsformer: tabletter, tabletter med fördröjd frisättning och orala lösningar. Dess tabletter godkändes först av FDA 2012, och doseringsformen med fördröjd frisättning godkändes av FDA i februari 2016. Den är den första som behandlar reumatoida leder. Yan är en JAK-hämmare som tas oralt en gång om dagen. I december 2019 godkändes en ny indikation för läkemedel med fördröjd frisättning igen för måttlig till svår aktiv ulcerös kolit (UC). Dessutom har de nuvarande kliniska fas 3-prövningarna för plackpsoriasis slutförts, och ytterligare sex fas 3-studier pågår, som involverar aktiv psoriasisartrit, juvenil idiopatisk artrit, etc. Typ av indikationer. Fördelarna med tabletter med fördröjd frisättning som är långtidsverkande och bara behöver tas en gång om dagen bidrar till hantering och kontroll av patienternas sjukdomar.
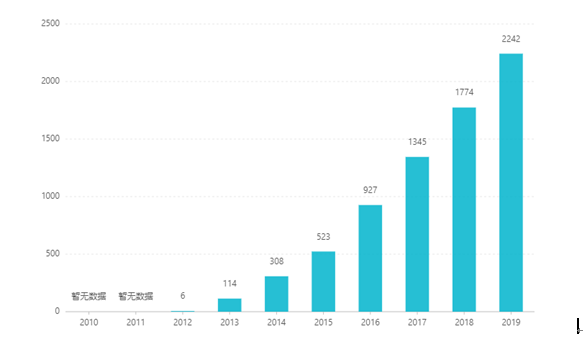
Sedan börsnoteringen har dess försäljning ökat år efter år och nådde 2,242 miljarder USD 2019. I Kina godkändes tablettdoseringsformen för marknadsföring i mars 2017 och kom in i katalogen för sjukförsäkringskategori B genom förhandlingar 2019. Den senaste vinnande budet är 26,79 RMB. Men på grund av de höga tekniska barriärerna för preparat med fördröjd frisättning har denna beredningsform ännu inte marknadsförts i Kina.
JAK-kinas spelar en viktig roll vid inflammation, och dess inhibitorer har visat sig behandla vissa inflammatoriska och autoimmuna sjukdomar. Hittills har 7 JAK-hämmare godkänts globalt, inklusive Leo Pharmas Delgocitinib, Celgenes Fedratinib, AbbVies upatinib, Astellas's Pefitinib, Eli Lillys Baritinib och Novartis's Rocotinib. Det är dock endast tofacitinib, baritinib och rokotinib som är godkända i Kina bland ovan nämnda läkemedel. Vi ser fram emot att Qilus "Tofatib Citrate Tabletter med fördröjd frisättning" ska godkännas så snart som möjligt och gynna fler patienter.
I Kina godkändes den ursprungliga forskningen tofacitibcitrat av NMPA i mars 2017 för behandling av vuxna RA-patienter med otillräcklig effekt eller intolerans mot metotrexat, under handelsnamnet Shangjie. Enligt data från Meinenet var försäljningen av tofacitibcitrattabletter i Kinas offentliga medicinska institutioner 2018 8,34 miljoner yuan, vilket var mycket lägre än dess globala försäljning. En stor del av anledningen är priset. Det rapporteras att Shangjie's initiala försäljningspris var 2085 yuan (5mg*28 tabletter), och månadskostnaden var 4170 yuan, vilket inte är en liten börda för vanliga familjer.
Det är dock värt att fira att tofacitib togs upp i 2019 års ”Nationell grundläggande sjukförsäkring, arbetsskadeförsäkring och moderskapsförsäkring läkemedelslista” av Rikssjukvårdsverket efter förhandlingar i november 2019. Det rapporteras att månadsavgiften ska sänkas till under 2 000 yuan efter att prissänkningen har förhandlats fram, vilket avsevärt kommer att förbättra tillgängligheten av läkemedlet.
I augusti 2018 fattade den statliga immaterialrättsmyndighetens patentomprövningsnämnd ett omprövningsbeslut nr 36902 begäran om ogiltigförklaring och förklarade ogiltigt Pfizertofatibs kärnpatent, det sammansatta patentet, på grund av otillräcklig avslöjande av specifikationen. Patentet för Pfizertofatiib kristallform (ZL02823587.8, CN1325498C, ansökningsdatum 2002.11.25) kommer dock att löpa ut 2022.
Insight-databasen visar att, utöver den ursprungliga forskningen, har fem generiska läkemedel av Chia Tai Tianqing, Qilu, Kelun, Yangtzefloden och Nanjing Chia Tai Tianqing godkänts för marknadsföring i de inhemska tofacitinib-tabletterna. För tabletttypen med fördröjd frisättning lämnade endast den ursprungliga forskningen Pfizer in en marknadsföringsansökan den 26 maj. Qilu är det första inhemska företaget att lämna in en marknadsföringsansökan för denna formulering. Dessutom är CSPC Ouyi i BE-teststadiet.
Changzhou Pharmaceutical Factory (CPF) är en ledande läkemedelstillverkare av API:er, färdiga formuleringar i Kina, som ligger i Changzhou, Jiangsu-provinsen. CPF har grundats 1949. Vi har ägnat oss åt Tofacitinib Citrate från 2013, och redan lämnat in DMF. Vi har registrerats i många länder och kan hjälpa dig med bästa dokumentstöd för Tofacitinib Citrate.
Posttid: 23 juli 2021